Non è solo una forma di anemia, ma una malattia complessa del sistema immunitario, che coinvolge linfociti, anticorpi, complemento e infiammazione. Una review dell’Università di Cagliari mostra come questa nuova visione stia aprendo la strada a terapie sempre più mirate e personalizzate.
Debolezza, affaticamento; a seconda dei casi, ittero, dolore, rischio di trombosi e danni a organi e articolazioni. Sono solo alcuni dei sintomi dell’anemia emolitica autoimmune, una patologia che con l’avanzare degli studi si è rivelata via via più complessa di quanto si ritenesse in passato, con meccanismi patologici che vanno oltre quello che dà il nome alla malattia stessa: una distruzione dei globuli rossi dovuta a un processo autoimmune, nel quale il sistema immunitario attacca il proprio stesso organismo.
All’avanzare di queste conoscenze, e di conseguenza delle terapie disponibili e in fase di studio per l’anemia emolitica autoimmune, medici e ricercatori dell’Università di Cagliari e dell’Ospedale Oncologico Businco hanno dedicato una review pubblicata su Frontiers in Immunology. Ce ne siamo fatti raccontare gli aspetti principali dal primo autore, l’ematologo Alessandro Costa.
Un nome, molte cause, diverse malattie
L’anemia emolitica autoimmune è una condizione rara, che può essere o meno di tipo secondario (ossia associata a un’altra malattia coesistente) e distinta in due tipi principali: quella calda, la più comune, e quella fredda, che rappresenta il 20-25% circa dei casi.
“Con la nostra review vogliamo fare il punto per quanto riguarda la ricerca su questa patologia, partendo proprio dalle caratteristiche. Perché, di fatto, la distruzione dei globuli rossi è solo la punta dell’iceberg, al di sotto della quale vi sono diversi fattori che contribuiscono al danno”, spiega Costa.
“Oggi la letteratura fornisce diverse informazioni al riguardo. Questo ha permesso anche di caratterizzare meglio, dal punto di vista fisiopatologico, le diverse forme di anemia emolitica autoimmune. Per esempio, oggi sappiamo che nelle forme calde la distruzione dei globuli rossi avviene prevalentemente a livello della milza ed è mediata da anticorpi di tipo IgG; al contrario, nelle forme fredde il fegato rappresenta il principale organo coinvolto nell’eliminazione degli eritrociti, un processo sostenuto da agglutinine di tipo IgM. Questo aspetto spiega anche la maggior presenza di sintomi vascolari, perché per la loro struttura le IgM tendono più facilmente ad agglutinare i globuli rossi a basse temperature (da cui l’aggettivo fredda). Sappiamo anche che il peso del sistema del complemento è differente nelle due forme, un aspetto che ha influenzato anche le scelte terapeutiche”.
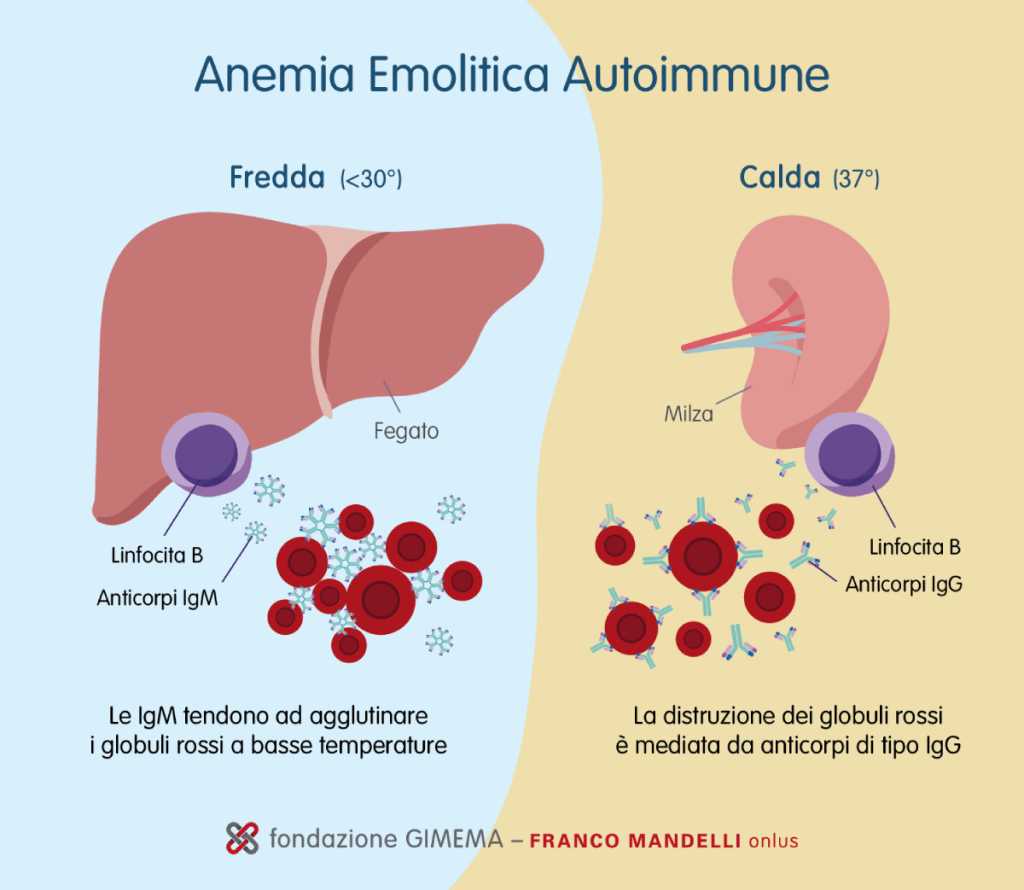
Insomma, alla visione tutto sommato semplice dell’anemia emolitica autoimmune del passato si è oggi sostituita una rappresentazione ben diversa, e più complessa. Infatti, tra le sue caratteristiche non vi è solo la produzione, da parte dei linfociti B, di anticorpi anomali che attaccano i globuli rossi: vi sono anche processi che determinano l’incapacità dei linfociti T di mantenere la tolleranza verso il self (i tessuti del proprio stesso organismo) e un’amplificazione della distruzione dei globuli rossi da parte del sistema del complemento (la cascata di reazioni enzimatiche che porta all’attivazione del sistema immunitario). Meccanismi che, insieme, influenzano anche i processi di infiammazione e coagulazione. Il risultato va dunque oltre la sola anemia e determina l’aumentato rischio trombotico, l’infiammazione sistemica e le recidive.
Di fatto, dunque, l’anemia emolitica autoimmune non è una sola malattia, ma un insieme di malattie con meccanismi diversi, con peso differente nelle diverse forme. E ognuno dei farmaci disponibili cerca di colpire il più significativo.
Da ieri a domani: i trattamenti tra soluzioni attuali e prospettive
La review propone un percorso tra i differenti farmaci, partendo dai primi disponibili: “Il più consolidato è il rituximab, che agisce contro i linfociti B CD20+”, spiega Costa. “Ma ha un grosso limite: non colpisce le plasmacellule a lunga vita. Da cui le recidive – ma anche la spinta allo sviluppo di altri farmaci, attivi proprio contro le plasmacellule”. Si parla del daratumumab, un anticorpo anti-CD38, prima vera terapia che mira a eliminare gli autoanticorpi fin dal loro “serbatoio”, con un certo successo (ma non ancora approvata per l’anemia emolitica autoimmune). Un’altra possibilità è rappresentata dalla terapia CAR-T, impiegata in alcune forme tumorali, ma a oggi però usata solo in modo compassionevole nell’ambito dell’anemia emolitica autoimmune e non scevra di rischi importanti.
Una strategia che si inizia invece ad affacciarsi all’orizzonte è quella che mira a bloccare i linfociti B mentre sono in azione. Queste cellule sopravvivono e producono anticorpi grazie a segnali interni, uno dei quali passa per la Bruton Tyrosine Kinase (BTK). Gli inibitori BTK agiscono proprio contro questo enzima. Alcuni di essi, di nuova generazione, sono in grado di agire anche contro i macrofagi responsabili della distruzione fisica dei globuli rossi, altro possibile target terapeutico, sui quali infatti agiscono ulteriori farmaci (gli inibitori di SYK, rappresentati dal fostamatinib). Ancora, vi sono le strategie terapeutiche volte a bloccare la cascata del complemento, particolarmente interessanti per l’anemia emolitica autoimmune fredda, dove questo elemento ha un ruolo significativo. Si tratta di farmaci (come il sutimlimab) che stanno dando ottimi risultati, ma che hanno tra i limiti principali la necessità di infusioni frequenti – limite che infatti gli studi stanno cercando di superare con nuovi anticorpi, progettati per avere un’emivita più lunga.
“Metaforicamente, nel contesto dell’anemia emolitica autoimmune c’è ogni giorno qualcosa di nuovo. Con questa review abbiamo cercato di puntualizzare l’aspetto clinico della ricerca, e emerge chiaramente come il trattamento di questa patologia stia passando dalla medicina empirica a quella di precisione”, conclude Costa.
“Come per molte altre malattie, infatti, non esiste una terapia che vada bene per tutti: bisogna capire ciò che funziona meglio per ogni paziente. È dunque necessario avere a disposizione quanti più protocolli possibile, il che a sua volta richiede, soprattutto in questo contesto di malattia rara, di arruolare quanti più pazienti e centri possibile per i trial”.
La review originale di Costa A, et al. Beneath the surface in autoimmune hemolytic anemia: pathogenetic networks, therapeutic advancements and open questions, pubblicata su Frontiers in Immunology è disponibile al seguente link https://doi.org/10.3389/fimmu.2025.1624667
