Il sequenziamento di nuova generazione (NGS) è ormai centrale nella diagnosi e nella gestione delle neoplasie mieloidi. Ma i referti NGS sono complessi e non sempre facili da interpretare. Una ricerca italiana aiuta a leggere i dati genetici e a interpretarli correttamente nella pratica clinica.
L’avanzamento di conoscenze e tecnologie biomediche è alla base di diagnosi, prognosi, scelte terapeutiche e trattamenti migliori. Ma saper usare le nuove conoscenze e tecnologie può non essere semplice. Un esempio molto concreto è l’uso del Next Generation Sequencing (NGS), l’insieme di tecnologie che permette di sequenziare grandi quantità di materiale genetico in parallelo e rapidamente, fornendo informazioni che possono essere preziose dal punto di vista clinico. A patto però di riuscire a interpretarle nel modo corretto.
È da questa considerazione che nasce la review di un gruppo di ematologi italiani, pubblicata sul Journal of Clinical Medicine. L’obiettivo non è solo fornire una panoramica sul NGS nell’ambito delle neoplasie mieloidi, in particolare leucemia mieloide acuta (AML, nell’acronimo inglese) e neoplasie mielodisplastiche (MDS, nell’acronimo inglese), ma anche una guida pratica per interpretare il referto. Ne parliamo con Laura Cicconi, ematologa dell’ospedale Santa Maria Goretti di Latina, che ha coordinato il lavoro insieme a Salvatore Perrone, ematologo all’ospedale Santa Maria Goretti di Latina.
Quando la genetica molecolare entra nella pratica clinica
“Il nostro è un lavoro prevalentemente clinico. Le tecnologie di biologia e genetica molecolare sono però ormai parte della nostra professione: il NGS, in particolare, è ormai pienamente integrato nelle linee guida sulla gestione delle neoplasie mieloidi e le classificazioni internazionali di AML e MDS dipendono direttamente dai risultati del sequenziamento”, spiega Cicconi.
“Il problema è che i referti sono complessi: contengono molti dati tecnici, e pongono il rischio di sovra – o sotto – interpretare risultati che possono avere conseguenze cliniche importanti. Inoltre, alcuni dati sono di difficile interpretazione anche perché a tutt’oggi non è chiara la loro rilevanza clinica”.
Non solo: non esistono standard o linee guida comuni che indichino come produrre il referto e interpretare i risultati del NGS. “Insomma, siamo in una fase di transizione. Abbiamo nuove tecnologie, ne conosciamo l’importanza, ma non le sappiamo ancora gestire pienamente”, continua l’ematologa.
Le mutazioni non dicono sempre la stessa cosa
La recente review si pone quindi nell’ottica di fornire indicazioni pratiche per orientarsi tra questi problemi – incertezza inclusa. Tra gli elementi più importanti sottolineati vi è l’attenzione al pannello NGS utilizzato. I diversi laboratori, infatti, possono eseguire analisi più o meno estese, che tengono cioè in considerazione un numero variabile di geni. “I pannelli, cioè gli insiemi di geni analizzati, rilevanti a fini prognostici e diagnostici analizzano circa 20-50 geni: pannelli più estesi a oggi possono essere utili ai fini di ricerca, non a scopo clinico”, spiega Cicconi. “Comunque, anche nei pannelli più ristretti, possiamo trovare informazioni non chiaramente interpretabili. In questi casi è cruciale concentrarsi sugli hotspot mutazionali più rilevanti dal punto di vista clinico”.
Tra i diversi aspetti sottolineati dalla review, emerge chiaramente un altro concetto chiave: la distinzione tra mutazioni somatiche (acquisite e presenti solo nelle cellule tumorali) e germinali (ereditarie e presenti in tutte le cellule dell’organismo).
Soprattutto nei pazienti più giovani, infatti, si ricorre spesso al trapianto, per cui è importante identificare con certezza mutazioni germinali, che diventano fondamentali per la scelta del donatore”, continua l’ematologa.
Infine, questa complessa ma necessaria lettura non deve portare a trascurare il contesto generale del paziente. Se il dato genetico è ormai indispensabile per i sistemi prognostici e la scelta terapeutica, è altresì vero che molti pazienti cambiano classe di rischio quando si includono i dati molecolari, ma solo una parte di questi cambiamenti si traduce in una modifica concreta della terapia. Il dato, anche genetico, non è insomma mai valido da solo: ha sempre bisogno di essere integrato con età, condizioni cliniche e condizioni generali.
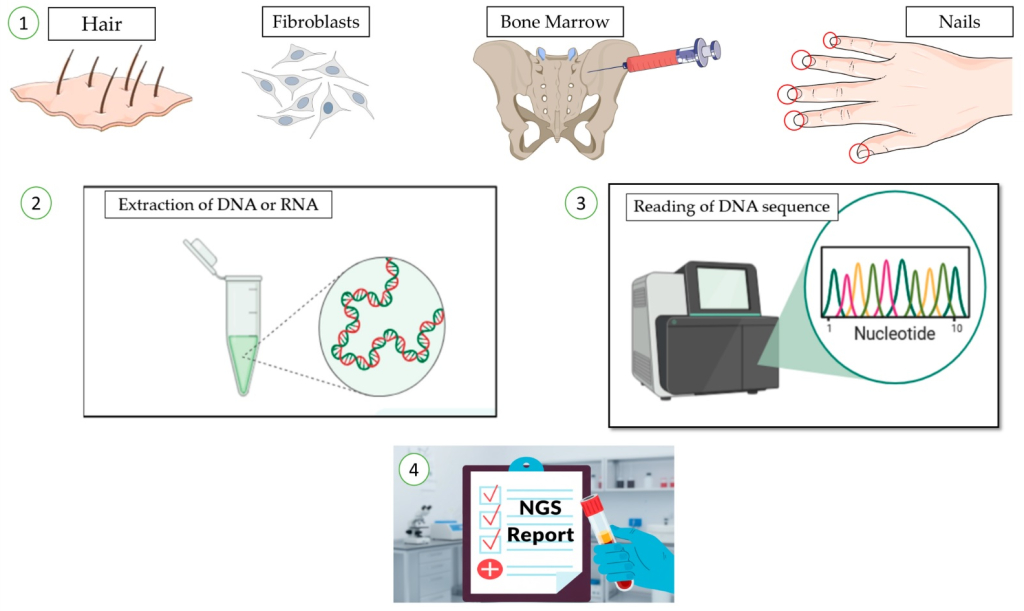
La figura riassume su quali tessuti viene effettuato Next-Generation Sequencing (NGS), gli strumenti e le metodiche utilizzate, fino a ottenere il referto conclusivo delle analisi effettuate. Tratto da: Perrone, S.; Tresoldi, C.; Rigamonti, S.; Molica, M.; Zhdanovskaya, N.; Cicconi, L. How to Read a Next-Generation Sequencing Report for AML and MDS? What Hematologists Need to Know. J. Clin. Med. 2025, 14, 8681. https://doi.org/10.3390/jcm14248681. Disponibile su MDPI. Licenza CC BY 4.0.
La review originale di Perrone S, et al. How to Read a Next-Generation Sequencing Report for AML and MDS? What Hematologists Need to Know, pubblicata sulla rivista Journal of Clinical Medicine, è disponibile al seguente link: https://doi.org/10.3390/jcm14248681
