In un articolo pubblicato su Leukemia viene rivisto il fenomeno dell’ematopoiesi clonale, descrivendolo come un fenomeno dinamico, sensibile a fattori esterni e stress ambientali.
Nel nostro organismo, anche in assenza di malattie, le cellule mutano costantemente. Questo accade anche alle cellule staminali ematopoietiche (CSE o HSC dall’inglese Hematopoietic Stem Cells), quelle che si trovano nel midollo osseo e danno origine alle cellule del sangue. Questo fenomeno viene chiamato ematopoiesi clonale (CH, dall’inglese clonal hematopoiesis). Con l’età queste cellule accumulano mutazioni che spesso sono casuali, ma alle volte possono conferire un vantaggio competitivo ad alcune di esse: in alcune condizioni le cellule mutate si moltiplicano molto più velocemente delle altre.
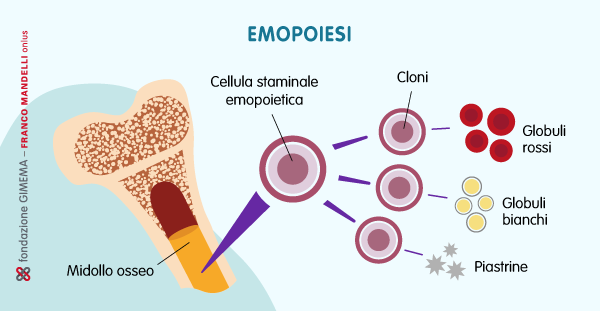
In un articolo pubblicato sulla prestigiosa rivista Leukemia, gli autori italiani Valentina Giudice e Carmine Selleri, ricercatori al Dipartimento di Medicina, Chirurgia e Odontoiatria, Scuola Medica Salernitana (DIPMED), propongono una nuova visione dell’ematopoiesi clonale, descrivendola non solo come un processo neoplastico statico, ma come un fenomeno dinamico e sensibile a fattori esterni e stress ambientali.
Gli autori sottolineano come l’ematopoiesi clonale rappresenta una “fotografia” della composizione del midollo in un determinato momento, che rivela che una certa quota di cellule del sangue discende da un clone mutato. Alcuni cloni si espandono, altri scompaiono, altri ancora restano silenti per anni.
Nel tempo i cloni accumulano nuove mutazioni e competono tra loro, portando a ramificazioni ed eventuale selezione di cloni dominanti. È il meccanismo definito come evoluzione clonale, attraverso cui un clone inizialmente neutro può diventare terreno fertile per lo sviluppo di patologie come la leucemia.
Possiamo immaginare il midollo osseo come un serbatoio connesso al sangue periferico tramite un sistema a vasi comunicanti: quando nel sangue c’è bisogno di cellule come durante un’infezione, in cui occorrono globuli bianchi, o quando mancano cellule, per esempio dopo una chemioterapia, il midollo risponde aumentando la produzione e il rilascio di cellule. In queste condizioni, cloni che normalmente sarebbero rimasti silenti possono iniziare a proliferare. La velocità con cui ciò avviene dipende da molteplici fattori: dal numero di cellule disponibili nel midollo, dalla “tipologia” dei cloni presenti, dalla loro capacità di rispondere a stimoli proliferativi, e dalla richiesta periferica. Alcuni di questi cloni possono aiutare il corpo a fronteggiare la crisi, altri però, se portatori di mutazioni pericolose, possono diventare pre-maligni o addirittura sfociare in leucemie. I cloni “lenti”, invece, restano nascosti fino a quando i più rapidi si esauriscono o vengono eliminati, e solo allora iniziano la loro proliferazione.
Questo ciclo continuo di ascesa e declino di diversi cloni cellulari rende l’ematopoiesi un processo altamente dinamico. Quando questa dinamica viene stressata da fattori esterni, come quelli indicati, i cloni pericolosi possono “scappare”al controllo ed espandersi rapidamente (emergency clonal escape).
Per quanto riguarda le mutazioni riscontrate nelle cellule del sangue, è stato osservato come di fatto non siano tutte uguali: alcune, come quelle nei geni DNMT3A o TET2, sono comuni nelle persone anziane e si sviluppano lentamente. Altre, come quelle in TP53, PPM1D o CHEK2, sono causate da veri e propri danni subiti dalle cellule e sono associate a proliferazioni cellulari rapide e aberranti. Inoltre, è dimostrato che cloni apparentemente innocui si trasformano solo in presenza di specifici stimoli esterni. Dopo una chemioterapia, ad esempio, il midollo riceve un vero e proprio “scossone” e si ricostituisce accumulando mutazioni equivalenti a 1–2 anni di invecchiamento. In questi contesti, cloni che portano mutazioni in geni come TP53, RUNX1 o FLT3 possono diventare dominanti e contribuire alla recidiva di malattie come la leucemia mieloide acuta.
Secondo gli autori, quindi, l’ematopoiesi clonale, è un adattamento funzionale del sistema ematopoietico alle esigenze e alle pressioni ambientali.
Le implicazioni cliniche possono essere rilevanti: la progressione leucemica non dipende solo dall’accumulo di mutazioni, ma anche da eventi ambientali che spingono i cloni a proliferare. E questo spiega perché in alcuni pazienti la malattia accelera improvvisamente dopo una terapia o un’infezione.
L’articolo originale di Giudice V, Selleri C, How fast does leukemia progress?, pubblicato su Leukemia, è disponibile a questo link https://www.nature.com/articles/s41375-025-02536-3