Un recente articolo pubblicato sul British Medical Journal solleva l’attenzione sul tema delle informazioni fornite al paziente nel momento della sua decisione sull’eventuale partecipazione ad uno studio clinico. L’adesione allo studio si formalizza con la firma su un modulo di consenso informato (vedi scheda) e sebbene le informazioni siano esaustive nella gran parte dei casi, gli autori evidenziano come queste siano spesso insufficienti nel caso si parli di placebo, dando così origine ad un possibile fraintendimento terapeutico.
- essere accuratamente informati degli obiettivi, metodi, rischi e benefici della ricerca e delle sue alternative;;
- comprendere le informazioni ricevute e le loro conseguenze per la propria situazione clinica;
- poter scegliere volontariamente e liberamente se partecipare.
- Il consenso informato è uno egli elementi più importanti nella costruzione della “alleanza terapeutica” tra medico/sperimentatore e paziente/partecipante, oltre che un documento fondamentale che deve essere firmato dal paziente per accettare la partecipazione allo studio. I pazienti devono :
Fraintendimento terapeutico.
«Fraintendimento terapeutico» è un termine coniato nel 1980 per indicare quando il paziente non comprende pienamente ciò che gli viene comunicato sulla propria terapia. Ricerche svolte sul processo del consenso informato hanno evidenziato come questa incomprensione sia comune tra i pazienti e spesso influenzi la decisione sull’eventuale partecipazione ad una sperimentazione clinica.
Nell’articolo del BMJ gli autori evidenziano come il problema sia piuttosto rilevante quando si parla di placebo. Spesso infatti questo è descritto sommariamente, con termini come «inerte» o «inattivo» se non addirittura come uno «svantaggio della partecipazione allo studio». Inoltre, come se non bastasse, nella gran parte dei casi non verrebbe ben spiegato il motivo per cui si lo si utilizza.
Perchè si usa il placebo?
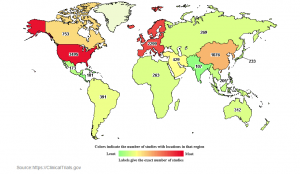
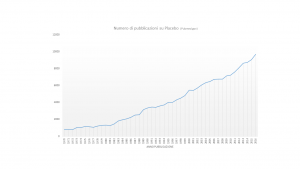
L’utilizzo del placebo è un cardine della sperimentazione clinica finalizzata a convalidare un farmaco o una strategia terapeutica. Le pubblicazioni scientifiche sull’argomento sono in costante crescita e le ricerche cliniche attive sono, al momento, più di 8000 in tutto il mondo.
In una ricerca clinica con placebo i pazienti sono suddivisi in due gruppi: uno riceverà il trattamento sperimentale, l’altro il placebo. Idealmente sia il paziente che il medico dovrebbero essere all’oscuro del trattamento somministrato (studio in doppio cieco) e per questo il placebo ha caratteristiche estetiche che lo rendono indistinguibile dal farmaco sperimentale.
Quando al paziente viene proposto l’utilizzo del placebo, questo ha già ricevuto un’autorizzazione da parte di un comitato etico, a garanzia dell’eticità del suo utilizzo per le finalità della ricerca. Spesso però questa informazione non viene riportata in modo adeguato al paziente e da qui può nascere il «fraintendimento terapeutico» che il più delle volte generalizza il placebo come un trattamento inutile. Errore. Lungi dall’essere inutile, il gruppo trattato con placebo è fondamentale per tenere sotto controllo numerosi fattori confondenti (Es.: errori di pazienti e medici, suggestioni, fluttuazione spontanea della malattia e dei suoi sintomi, ecc..) che possono inficiare la lettura dei risultati della ricerca. Oltretutto è anche vero che lo stesso placebo ha riservato sorprese in fase di analisi dei dati.
Il placebo è realmente neutro?
Anche se per definizione il placebo è descritto come un trattamento neutro la realtà dimostra che questo può non essere vero. Scorrendo la letteratura scientifica si incontrano numerosi studi che mostrano risultati indistinguibili tra il trattamento sperimentale e quello con placebo. In alcune condizioni e nell’ambito di alcune malattie il placebo attiva una risposta fisiologica. Perchè e come questo accada non è chiaro ma l’interpretazione moderna suggerisce che il processo di condizionamento attivato dal placebo sia modulato da fattori cognitivi complessi. Putroppo le nostre conoscenze non ci consentono di prevedere se una persona attiverà una reazione e con quale intensità. In ogni caso questa eventuale reazione influenzerà la ricerca clinica sebbene, mancando una misurazione sull’intensità dell’effetto placebo, l’impatto di questa influenza non emergerà chiaramente nei risultati.
Informare o non informare.
Ed è anche per questo che esiste una corrente di pensiero che ritiene non sia utile fornire un’informazione approfondita al paziente in modo da non sollecitare una specifica aspettativa e, di conseguenza, innescare un probabile effetto. Però, oltre al fatto che la metodologia non dovrebbe mai prevalere sul diritto d’informazione del paziente, a questa corrente si oppone un problema di ordine pratico: evitare peggioramenti del trattamento.
Nell’articolo da cui siamo partiti, gli autori prendono ad esempio una compressa di placebo. Per definizione questa è priva di un principio attivo (farmaco) ma tra i suoi componenti è presente il lattosio (eccipiente). Se la compressa venisse presa da pazienti con un’intolleranza a questa sostanza si potrebbero osservare degli effetti collaterali. Questi, seppur minimi, farebbero apparire i risultati del trattamento placebo peggiori di quello che sarebbero in realtà (il paziente non prenderebbe la compressa in caso di intolleranza). Se poi consideriamo che la sensibilità al lattosio è spesso presente in malati di tumore e si accentua in persone sottoposte a radio o chemioterapia, possiamo amplificare l’effetto negativo dato dalla mancata informazione sulla composizione della pillola. In una funzione comparativa (trattamento sperimentale contro trattamento neutro) questo peggioramento dei sintomi nel trattamento «neutro» rischia di far emergere benefici, probabilmente non reali, del trattamento sperimentale.
E’ ovvio che l’esempio qui riportato è estremizzato a fini divulgativi ma è anche vero che deriva da una reale esperienza sperimentale presente in letteratura scientifica.
Da un punto di vista sia etico che scientifico, appare quindi importante porre più attenzione sulla qualità dell’informazione fornita al paziente per quel che riguarda il placebo.